
|
| 25 SOAL ULANGAN HARIAN IKATAN KIMIA DAN BENTUK MOLEKUL |
1. Unsur kalsium mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 . Untuk mencapai kondisi yang stabil seperti golongn gas mulia, maka yang terjadi pada kalsium adalah … .
A. Pelepasan 1 elektron sehingga bermuatan +1
B. Pelepasan 2 elektron sehingga bermuatan +2
C. Penyerapan 1 elektron sehingga bermuatan +2
D. Penyerapan 2 elektron sehingga bermuatan +2
E. Memasangkan dua elektron dengan dua elektron lain.
2. Diketahui konfigurasi elektron sebagai berikut :
2He : 1s2
6C : 1s2 2s2 2p2
8O : 1s2 2s2 2p2
10Ne : 1s2 2s2 2p6
11Na : 1s2 2s2 2p6 3s1
13Al : 1s2 2s2 2p6 3s2 3p1
16S : 1s2 2s2 2p6 3s2 3p4
17Cl : 1s2 2s2 2p6 3s2 3p5
18Ar : 1s2 2s2 2p6 3s2 3p6
19K : 1s2 2s2 2p6 3s2 3p6 4s1
Maka kelompok unsur yang cenderung membentuk ion positip adalah ….
A. He,Al, dan O
B. He,Ne, dan Ar
C. Na, Al dan K
D. C,O dan Cl
E. Ne, Na dan K
3. Perhatikan gambar struktur Lewis beberapa senyawa berikut!
Senyawa yang tidak mengikuti kaidah oktet atau duplet adalah ....
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
4. Diketahui unsur X dan Z memiliki konfigurasi elektron sebagai berikut:
X : [Ar] 4s2 3d6
Z : [Ne] 3s2 3p5
Apabila X dan Z bersenyawa, rumus senyawa yang terbentuk adalah ….
A. X3Z
B. X3Z2
C. X2Z3
D. XZ3
E. X2Z
5. Senyawa M mempunyai sifat sebagai berikut:
a) mudah larut dalam air,
b) dapat menghantarkan listrik dalam fase cair,
c) titik didih dan titik lelehnya tinggi.
Jenis ikatan dalam senyawa M tersebut adalah ….
A. ion
B. kovalen nonpolar
C. hidrogen
D. logam
E. kovalen polar
6. Gambar struktur Lewis senyawa SO2 yang paling tepat adalah … (nomor atom S = 16; O = 8)
A.
B.
C.
D.
E.
7. Perhatikan gambar struktur Lewis senyawa H2SO4 berikut ini!
Ikatan kovalen koordinasi ditunjukkan oleh nomor … (nomor atom H = 1; S = 16; O = 8)
A. 1
B. 2
C. 3
D. 4
E. 5
8. Perhatikan tabel berikut ini!
|
Zat |
Titik Leleh |
Kelarutan dalam air |
Padatan |
Lelehan |
Larutan |
|
X |
−115 |
Larut |
− |
− |
+ |
|
Y |
−94 |
Tidak larut |
− |
− |
− |
Keterangan (−) : non konduktor, (+) : isolator
Berdasarkan data tersebut, dapat disimpulkan bahwa …
A. Zat X : senyawa kovalen polar, Zat Y : senyawa kovalen nonpolar
B. Zat X : senyawa kovalen polar, Zat Y : senyawa kovalen polar
C. Zat X : senyawa kovalen nonpolar, Zat Y : senyawa kovalen nonpolar
D. Zat X : senyawa ionik, Zat Y : senyawa kovalen polar
E. Zat X : senyawa kovalen polar, Zat Y : senyawa ionic
9. Perhatikan letak unsur (bukan lambang unsur sebenarnya) dalam tabel periodik berikut ini!
Maka gambar struktur Lewis, rumus molekul senyawa dan jenis ikatan kimia yang benar adalah… .
10. Unsur P (Z = 15) bersenyawa dengan unsur Cl (Z = 17) membentuk PCl3. Banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3 adalah ….
A. 0
B. 1
C. 2
D. 3
E. 4
11. Suatu molekul mempunyai 4 pasang elektron di sekitar atom pusat, 2 diantaranya merupakan PEB, maka bentuk molekul yang paling mungkin adalah ….
A. segitiga datar
B. segiempat planar
C. tetrahedron
D. bentuk T
E. bentuk V
12. Sudut ikatan molekul H2O adalah 104,5 lebih kecil dari sudut tetrahedron, hal ini disebabkan oleh ….
A. adanya 2 pasangan elektron bebas
B. adanya 2 pasangan elektron ikatan
C. adanya ikatan hidrogen pada H2O
D. adanya dipol permanen pada H2O
E. pasangan elektron jauh dari atom pusat
13. Suatu senyawa memiliki jumlah domain elektron ikatan 3 dan domain elektron bebas 0, bentuk molekul dari senyawa tersebut adalah ….
A. Linear
B. Tetrahedral
C. Segitiga datar
D. Oktahedral
E. Bipiramida segitiga
14. Bila suatu senyawa memiliki bentuk molekul seperti di bawah ini
Maka senyawa yang mungkin adalah....
A. BeCl2
B. H2O
C. NF3
D. CH4
E. PCl5
15. Konfigurasi atom unsur P dan Q adalah sebagai berikut.
P : 1s2 2s2 2p2
Q : 1s2 2s2 2p6 3s2 3p5
Jika P dan Q membentuk senyawa PQ4, bentuk molekulnya dan kepolarannya adalah….
A. tetrahedron, polar
B. segitiga piramida, non polar
C. terahedral, non polar
D. segitiga planar, polar
E. segi empat planar, non polar
16. Perhatikan gambar ilustrasi dari trikloro metana CHCl3 :
Gaya antar dipol ditunjukkan oleh nomor ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
17. Berikut ini merupakan gambar struktur ikatan tak sebenarnya dari molekul H2O :
Ikatan hidrogen pada struktur tersebut terdapat pada nomor ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
18. Gaya London atau gaya dispersi pada molekul-molekul non polar terjadi karena terbentuk ... dan ...
A. Dipol permanen dan dipol permanen
B. Dipol sesaat dan dipol terinduksi
C. Dipol permanen dan dipol sesaat
D. Dipol terinduksi dan dipol terinduksi
E. Ikatan hIdrogen
19. Diketahui pasangan-pasangan senyawa berikut.
(1) NH3 dan HF
(2) H2O dan HCl
(3) HF dan H2O
(4) NH3 dan HBr
(5) NH3 dan H2S
Kelompok senyawa yang dapat membentuk ikatan hidrogen adalah ...
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
20. Manakah zat berikut yang hanya memiliki gaya dispersi sebagai gaya antarmolekul?
A. CH4
B. HCl
C. NH3
D. C6H13NH2
E. NaCl
21. Perhatikan grafik di bawah ini!
Senyawa yang mengandung ikatan hidrogen antar molekulnya adalah nomor …
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (5) dan (6)
22. Pernyataan berikut ini yang benar adalah ...
A. Titik didih molekul yang memiliki ikatan hidrogen lebih besar daripada molekul yang memiliki gaya Van der Waals
B. Polarisabilitas suatu molekul dipengaruhi oleh kepolaran molekul
C. Gaya London hanya berlaku untuk molekul polar saja
D. Gaya induksi terjadi antara molekul polar dengan molekul polar
E. Urutan kekuatan gaya antarmolekul yaitu ikatan hidrogen > gaya London > gaya tarik-menarik dipol-dipol
23. Gaya antarmolekul yang bertanggung jawab kurang rapatnya es (air padat) dibanding air (air bentuk cair) adalah ….
A. gaya dispersi London
B. gaya dipol-dipol
C. gaya ion-dipol
D. ikatan hidrogen
E. ikatan ion
24. Gaya yang terjadi antara molekul HCl dengan molekul HCl lain disebut ...
A. Gaya tarik-menarik dipol-dipol
B. Gaya induksi
C. Gaya London
D. Gaya Van der Waals
E. Ikatan hidrogen
25. Berdasar pada massa molar dan momen dipol dari lima senyawa dalam tabel, manakah yang diperkirakan mempunyai titik didih tertinggi?
|
Zat |
Massa molar (g/mol) |
Momen dipol (Debye) |
|
Propana (CH3CH2CH3) |
44 |
0,1 |
|
Dimetileter (CH3OCH3) |
46 |
1,3 |
|
Metilklorida (CH3Cl) |
50 |
1,9 |
|
Asetaldehid (CH3CHO) |
44 |
2,7 |
|
Asetonitril (CH3CN) |
41 |
3,9 |
A. CH3CH2CH3
B. CH3OCH3
C. CH3Cl
D. CH3CHO
E. CH3CN
Demikian semoga bermanfaat dan dapat membantu anda semua yang membutuhkan serta tulislah komentar anda sebagai bentukdukungan ke blog ini

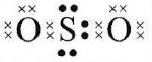










EmoticonEmoticon